 III Periodo
III Periodo 
Taller 3
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA TERCER PERIODO SEMANA DE TRABAJO DEL 17 AL 31 DE AGOSTO 2021ASIGNATURA: QUIMICA CURSO: GRADO ONCE DOCENTE: GUSTAVO GOMEZ PUENTES
Dirección de blog institucional:
https://joseantoniogalanbosa.blogspot.com/
El presente trabajo debe ser solucionado y enviado a su director de curso, al correo que habitualmente utilizan para el manejo de información y comunicación de estudiantes y padres de familia.
NOTA: El presente trabajo se debe hacer en el cuaderno, cuando se pida la explicación de un tema máximo el resumen debe ocupar media hoja y tomar una foto donde se vea claramente el trabajo desarrollado en el cuaderno y enviar al director del grupo o al siguiente correo ggomezpuentes@gmail.com, whatssap 3213432395
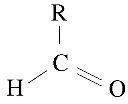
TEMA: ALDEHIDOS
OBJETIVO: Reconocer el grupo funcional CHO presentes
en los aldehídos y su importancia en la formación de compuestos químicos de uso
cotidiano.
MARCO CONCEPTUAL.
Aldehído es un término que deriva del vocablo
inglés aldehyde. Esta palabra, a su vez, es un acrónimo de una expresión
latina: alcohol dehydrogenatum. En este sentido, podemos exponer, por tanto, que
proviene de una expresión como es “alcohol deshidrogenado”.
 Los aldehídos son
compuestos químicos de tipo orgánico que surgen cuando determinados alcoholes se oxidan.
Los aldehídos son
compuestos químicos de tipo orgánico que surgen cuando determinados alcoholes se oxidan.
Para nombrar a los aldehídos, se elimina la
terminación –ol que tiene el nombre del hidrocarburo y se le añade –al.
De este modo, de acuerdo a la nomenclatura de la Unión Internacional de Química
Pura y aplicada,
se puede hablar de aldehídos como el metanal (o formaldehído, según la nomenclatura
trivial), el etanal (acetaldehído) o el propanal (propaldehído), por nombrar a
los más simples de acuerdo a su número de carbonos.
Propiedades físicas y químicas
Al ser compuestos polares sus puntos de fusión
son mayores que los de los compuestos no polares. Las moléculas de aldehídos no
son capaces de unirse intermolecularmente mediante puentes de hidrógeno, por tener
sólo átomos de carbono unidos a átomos de hidrógeno.
Debido a lo anterior, los aldehídos tienen puntos
de ebullición inferiores a los alcoholes y ácidos carboxílicos.
Puntos de fusión
Formaldehído -92; Acetaldehído -121; Propio
aldehído -81; n- Butiraldehído -99; n-Valer aldehído - 91; Caproaldehído –;
Metaldehído – 42; Fenilacetaldehído -; Benzaldehído -26.
Puntos de ebullición
Formaldehído -21; Acetaldehído 20; Propionaldehido
49; n-Butiraldehido 76; n-Valer aldehído 103;
Caproaldehido 131; Heptaldehido 155; Fenilacetaldehído
194; Benzaldehído 178.
Usos: Existen en la naturaleza aldehídos capaces
de conferir sabores agradables, tal es el caso del cinnamaldehído, responsable
del sabor característico de la canela. Por eso se suelen utilizar como saborizantes
artificiales en muchos productos como golosinas o alimentos.
Formaldehído; El formaldehído es el aldehído
que se produce industrialmente en mayor cantidad. El formaldehido obtenido por
la oxidación del metanol se utiliza en una solución al 37% del gas en agua,
bajo el nombre de formalina. Esta se usa en el curtido de pieles y en la
conservación y embalsamiento de cadáveres. NOTA: Recuerde que los aldehídos
terminan en al ejemplo: metanal, etanal, propanal, butanal, etc.
TALLER DE ACTIVIDADES.
De acuerdo al siguiente video conteste y
resuelva:
1.
Haga un resumen de las principales
características de los aldehídos.2.
Nombre correctamente los aldehídos
de 5 carbonos hasta 18 carbonos. 3- Explique las propiedades químicas y físicas
de los aldehídos.
3.
Elabore un resumen de la aplicación
o uso de los aldehídos, (alimentos, perfumería, laboratorios)
4.
Escriba la formula y el nombre correcto
de 5 aldehídos.
5.
Escriba la formula y el nombre correcto
de 5 aldehídos con sustituyentes.
EVALUCACION: Se tendrá en cuenta la puntualidad,
creatividad, el orden y presentación del presente trabajo
https://joseantoniogalanbosa.blogspot.com/
TEMA: ALDEHIDOS
OBJETIVO: Reconocer el grupo funcional CHO presentes en los aldehídos y su importancia en la formación de compuestos químicos de uso cotidiano.
MARCO CONCEPTUAL.
Aldehído es un término que deriva del vocablo
inglés aldehyde. Esta palabra, a su vez, es un acrónimo de una expresión
latina: alcohol dehydrogenatum. En este sentido, podemos exponer, por tanto, que
proviene de una expresión como es “alcohol deshidrogenado”.
![]() Los aldehídos son
compuestos químicos de tipo orgánico que surgen cuando determinados alcoholes se oxidan.
Los aldehídos son
compuestos químicos de tipo orgánico que surgen cuando determinados alcoholes se oxidan.
Para nombrar a los aldehídos, se elimina la terminación –ol que tiene el nombre del hidrocarburo y se le añade –al. De este modo, de acuerdo a la nomenclatura de la Unión Internacional de Química Pura y aplicada, se puede hablar de aldehídos como el metanal (o formaldehído, según la nomenclatura trivial), el etanal (acetaldehído) o el propanal (propaldehído), por nombrar a los más simples de acuerdo a su número de carbonos.
Propiedades físicas y químicas
Al ser compuestos polares sus puntos de fusión son mayores que los de los compuestos no polares. Las moléculas de aldehídos no son capaces de unirse intermolecularmente mediante puentes de hidrógeno, por tener sólo átomos de carbono unidos a átomos de hidrógeno.
Debido a lo anterior, los aldehídos tienen puntos
de ebullición inferiores a los alcoholes y ácidos carboxílicos.
Puntos de fusión
Formaldehído -92; Acetaldehído -121; Propio aldehído -81; n- Butiraldehído -99; n-Valer aldehído - 91; Caproaldehído –; Metaldehído – 42; Fenilacetaldehído -; Benzaldehído -26.
Puntos de ebullición
Formaldehído -21; Acetaldehído 20; Propionaldehido 49; n-Butiraldehido 76; n-Valer aldehído 103;
Caproaldehido 131; Heptaldehido 155; Fenilacetaldehído
194; Benzaldehído 178.
Usos: Existen en la naturaleza aldehídos capaces de conferir sabores agradables, tal es el caso del cinnamaldehído, responsable del sabor característico de la canela. Por eso se suelen utilizar como saborizantes artificiales en muchos productos como golosinas o alimentos.
Formaldehído; El formaldehído es el aldehído que se produce industrialmente en mayor cantidad. El formaldehido obtenido por la oxidación del metanol se utiliza en una solución al 37% del gas en agua, bajo el nombre de formalina. Esta se usa en el curtido de pieles y en la conservación y embalsamiento de cadáveres. NOTA: Recuerde que los aldehídos terminan en al ejemplo: metanal, etanal, propanal, butanal, etc.
TALLER DE ACTIVIDADES.
De acuerdo al siguiente video conteste y resuelva:
2. Nombre correctamente los aldehídos de 5 carbonos hasta 18 carbonos. 3- Explique las propiedades químicas y físicas de los aldehídos.
3. Elabore un resumen de la aplicación o uso de los aldehídos, (alimentos, perfumería, laboratorios)
4. Escriba la formula y el nombre correcto de 5 aldehídos.
5. Escriba la formula y el nombre correcto de 5 aldehídos con sustituyentes.
EVALUCACION: Se tendrá en cuenta la puntualidad,
creatividad, el orden y presentación del presente trabajo
________________________________________
 III Periodo
III Periodo 
Taller 1
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA TERCER PERIODO SEMANA DE TRABAJO DEL 15 AL 29 DE JULIO 2021ASIGNATURA: QUIMICA CURSO: GRADO ONCE DOCENTE: GUSTAVO GOMEZ PUENTES
Dirección de blog institucional:
https://joseantoniogalanbosa.blogspot.com/
TALLER DE ACTIVIDADES:
1- Represente los 5 primeros cicloalquenos.
2- Escriba el nombre de los siguientes cicloalquenos.

3- Según las normas de la IUPAC cuáles son los pasos para nombrar cicloalquenos 4- Hacer 3 ejemplos de cicloalquenos con sustituyentes.
5- Investigar las propiedades físicas y químicas de los cicloalquenos.
6- Investigar las propiedades físicas y químicas de los cicloalcanos.
7- Escriba el nombre de los primeros 7 cicloalcanos y represéntelos en su anillo cíclico
EVALUACION: Se tendrá en cuenta la puntualidad, creatividad, orden y presentación del presente
trabajo.
________________________________________
 II Periodo
II Periodo 
Taller 2
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA N°2 SEGUNDO PERIODO APRENDER EN CASASEMANA DE TRABAJO DEL 03 AL 14 DE MAYO 2021ASIGNATURA: QUIMICA CURSO: GRADO ONCE DOCENTE: GUSTAVO GOMEZ PUENTES
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: ALQUENOS Y ALQUINOS
OBJETIVO: Identificar alquenos y alquinos según el tipo de enlace presente
nombrándolos correctamente.
MARCO CONCEPTUAL
Alquenos
Los alquenos son hidrocarburos insaturados que tienen
doble enlace carbono-carbono en su molécula. Se puede decir que un alqueno es
un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un
enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de
cicloalquenos.
Los alquenos se nombran reemplazando la terminación
-ano del correspondiente alcano por -eno. Los alquenos más simples son el
eteno y el propeno, también llamados etileno y propileno a nivel industrial.
Los siguientes modelos muestran la estructura,
distancias y ángulos de enlace del eteno. Cada uno de los carbonos de la
molécula tiene hibridación sp2.
EJEMPLOS:
1,3 Dipenteno
Alquino
Los alquinos son hidrocarburos alifáticos con al menos
un triple enlace -C≡C- entre dos átomos de carbono. Se trata de compuestos de
ácido metaestables debido a la alta energía del triple enlace carbono-carbono.
Su fórmula general es CₙH₂ₙ₋₂ . Los
alquinos tienen unas propiedades físicas similares a los alcanos y alquenos.
Son poco solubles en agua, tienen una baja densidad y presentan bajos
puntos de ebullición. Sin embargo, los alquinos son más polares debido a
la mayor atracción que ejerce un carbono sp sobre los electrones, comparado con
un carbono sp3 o sp2.
El enlace carbono - hidrógeno de alquinos terminales
está polarizado y muestra una ligera tendencia a ionizarse.
EJEMPLOS:
3-Etil, 10-Metil, 4,7 Didudecino.
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente
video contesten las preguntas a continuación:
1-
Explique
las principales características presentes en los alquenos y alquinos.
2-
Nombre
y explique las propiedades químicas y físicas de los alquenos.
3-
Nombre
y explique las propiedades químicas y físicas de los alquinos.
4-
Escriba
3 ejemplos de alquenos utilizando las normas de la IUPAC.
5-
Escriba
3 ejemplos de alquinos utilizando las normas de la IUPAC.
6-
¿Cuál
es la principal fuente de obtención de los alquenos y alquinos y en que los
utilizamos?
________________________________________
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: ALQUENOS Y ALQUINOS
OBJETIVO: Identificar alquenos y alquinos según el tipo de enlace presente
nombrándolos correctamente.
MARCO CONCEPTUAL
Alquenos
Los alquenos son hidrocarburos insaturados que tienen
doble enlace carbono-carbono en su molécula. Se puede decir que un alqueno es
un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un
enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de
cicloalquenos.
Los alquenos se nombran reemplazando la terminación
-ano del correspondiente alcano por -eno. Los alquenos más simples son el
eteno y el propeno, también llamados etileno y propileno a nivel industrial.
Los siguientes modelos muestran la estructura,
distancias y ángulos de enlace del eteno. Cada uno de los carbonos de la
molécula tiene hibridación sp2.
EJEMPLOS:
1,3 Dipenteno
Alquino
Los alquinos son hidrocarburos alifáticos con al menos
un triple enlace -C≡C- entre dos átomos de carbono. Se trata de compuestos de
ácido metaestables debido a la alta energía del triple enlace carbono-carbono.
Su fórmula general es CₙH₂ₙ₋₂ . Los
alquinos tienen unas propiedades físicas similares a los alcanos y alquenos.
Son poco solubles en agua, tienen una baja densidad y presentan bajos
puntos de ebullición. Sin embargo, los alquinos son más polares debido a
la mayor atracción que ejerce un carbono sp sobre los electrones, comparado con
un carbono sp3 o sp2.
El enlace carbono - hidrógeno de alquinos terminales
está polarizado y muestra una ligera tendencia a ionizarse.
EJEMPLOS:
3-Etil, 10-Metil, 4,7 Didudecino.
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente
video contesten las preguntas a continuación:
1-
Explique
las principales características presentes en los alquenos y alquinos.
2-
Nombre
y explique las propiedades químicas y físicas de los alquenos.
3-
Nombre
y explique las propiedades químicas y físicas de los alquinos.
4-
Escriba
3 ejemplos de alquenos utilizando las normas de la IUPAC.
5-
Escriba
3 ejemplos de alquinos utilizando las normas de la IUPAC.
6-
¿Cuál
es la principal fuente de obtención de los alquenos y alquinos y en que los
utilizamos?
 II Periodo
II Periodo 
Taller 1
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA N°1 SEGUNDO PERIODO APRENDER EN CASASEMANA DE TRABAJO DEL 19 DE ABRIL A 30 DE ABRIL 2021ASIGNATURA: QUIMICA CURSO: GRADO ONCE DOCENTE: GUSTAVO GOMEZ PUENTES
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: PROPIEDADES FISICAS Y
QUIMICAS DE ALCANOS
OBJETIVO: Reconocer las diferentes propiedades
que presentan los alcanos y la mayoría de compuestos orgánicos, al igual que
sus métodos de obtención.
MARCO CONCEPTUAL
Los alcanos son compuestos formados por carbono e
hidrógeno que sólo contienen enlaces simples carbono – carbono. Cumplen la
fórmula general CnH2n+2, donde n es el número de carbonos
de la molécula.
Propiedades
Físicas:
Los alcanos son no polares, ya que
están formados sólo por carbono e hidrógeno. Debido a esto son insolubles en
agua, son excelentes disolventes de grasas y algunas ceras. y tienen puntos de
ebullición bajos.
Los alcanos de bajo peso molecular
(metano, etano, propano y butano) son gases, pero a medida que el número de
carbonos en la serie homóloga aumenta también lo hace el número de pequeños
dipolos instantáneos porque crece el número de enlaces C-C y C-H y así las
moléculas se mantienen más fijas, y el compuesto se presenta a temperatura ambiente
como líquido (pentano, hexano, etc.) y los alcanos con más de 18 átomos de carbono
son sólidos a temperatura ambiente. De la misma manera al aumentar el tamaño de
la molécula se incrementa el punto de fusión, ebullición, así como la
densidad.
Los alcanos tienen una baja densidad,
la cual crece al aumentar el peso molecular. Sin embargo, siempre su valor es
menor que la densidad del agua.
Propiedades
químicas:
Son compuestos poco reactivos debido a
que no tiene sitios de reacción con electrones disponibles, es por ello que no
sufren de transformaciones en presencia de ácidos, bases, metales sin la
presencia de energía. Los alcanos son excelentes combustibles y en presencia
del oxígeno desprenden dióxido de carbono y agua.
TALLER
DE ACTIVIDADES.
De
acuerdo a la anterior lectura y al siguiente video contesten las preguntas a continuación:
1- Represente
gráficamente la obtención de los alcanos a partir de la perforación de pozos de
petróleo.
2- Nombre
4 alcanos gaseosos y explique su uso.
3- Nombre
5 alcanos de naturaleza liquida y explique en que se utilizan.
4- Nombre
4 alcanos de naturaleza solida explicando su utilización.
5- Nombre
3 propiedades químicas de los alcanos, explicando la reacción de cada una de
ellas.
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: PROPIEDADES FISICAS Y
QUIMICAS DE ALCANOS
OBJETIVO: Reconocer las diferentes propiedades
que presentan los alcanos y la mayoría de compuestos orgánicos, al igual que
sus métodos de obtención.
MARCO CONCEPTUAL
Los alcanos son compuestos formados por carbono e
hidrógeno que sólo contienen enlaces simples carbono – carbono. Cumplen la
fórmula general CnH2n+2, donde n es el número de carbonos
de la molécula.
Propiedades
Físicas:
Los alcanos son no polares, ya que
están formados sólo por carbono e hidrógeno. Debido a esto son insolubles en
agua, son excelentes disolventes de grasas y algunas ceras. y tienen puntos de
ebullición bajos.
Los alcanos de bajo peso molecular
(metano, etano, propano y butano) son gases, pero a medida que el número de
carbonos en la serie homóloga aumenta también lo hace el número de pequeños
dipolos instantáneos porque crece el número de enlaces C-C y C-H y así las
moléculas se mantienen más fijas, y el compuesto se presenta a temperatura ambiente
como líquido (pentano, hexano, etc.) y los alcanos con más de 18 átomos de carbono
son sólidos a temperatura ambiente. De la misma manera al aumentar el tamaño de
la molécula se incrementa el punto de fusión, ebullición, así como la
densidad.
Los alcanos tienen una baja densidad,
la cual crece al aumentar el peso molecular. Sin embargo, siempre su valor es
menor que la densidad del agua.
Propiedades
químicas:
Son compuestos poco reactivos debido a
que no tiene sitios de reacción con electrones disponibles, es por ello que no
sufren de transformaciones en presencia de ácidos, bases, metales sin la
presencia de energía. Los alcanos son excelentes combustibles y en presencia
del oxígeno desprenden dióxido de carbono y agua.
TALLER
DE ACTIVIDADES.
De
acuerdo a la anterior lectura y al siguiente video contesten las preguntas a continuación:
1- Represente
gráficamente la obtención de los alcanos a partir de la perforación de pozos de
petróleo.
2- Nombre
4 alcanos gaseosos y explique su uso.
3- Nombre
5 alcanos de naturaleza liquida y explique en que se utilizan.
4- Nombre 4 alcanos de naturaleza solida explicando su utilización.
5- Nombre 3 propiedades químicas de los alcanos, explicando la reacción de cada una de ellas.
-----------------------------------------------------------
 I Periodo
I Periodo
Taller 4
La solución del presente trabajo, debe ser enviado al
correo electrónico ggomezpuentes@gmail.com o WhatsApp
3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: RADICALES DE ALQUILO
OBJETIVO: Reconocer la importancia de los
radicales de Alquilo como sustituyentes en compuestos orgánicos.
MARCO CONCEPTUAL
Un radical alquilo (antes llamado radical libre alquilo) es una entidad molecular inestable derivada de un alcano que ha perdido un átomo de hidrógeno y ha quedado con un electrón desapareado o impar.1 El radical formado está centrado sobre el átomo de carbono, es decir, el electrón desapareado está localizado sobre dicho átomo, por poseer mayor densidad de espín.2 El electrón desapareado se muestra como un punto en los diagramas o fórmulas estructurales.
Se forman por ruptura homopolar, generalmente
producida por altas temperaturas (termólisis o pirólisis), o por irradiación
con luz ultravioleta (fotólisis).
Es muy frecuente su formación en reacciones
radicalarias a partir de otros radicales, como la halogenación radicalaria que
produce haluros de alquilo a partir de alcanos y halógenos.
Los nombres de estos radicales ciclopropanos se
forman cambiando el sufijo ano del alcano por la terminación ilo o il
CH4
(Metano) – H -> CH3 – Metil (Metilo)
CH3-CH3
(Etano) – H -> CH3-CH2 –
TALLER
DE ACTIVIDADES.
De
acuerdo a la anterior lectura y al siguiente video contesten las preguntas a
continuación:
1- Que son
y cómo se forman los radicales de alquilo.
2- Nombre
y explique la función de algunos radicales de alquilo.
3- Escriba
la fórmula de los radicales de alquilo de 5 carbonos llamado pentil, hasta diez
carbonos llamado decil.
4- Escriba
la fórmula de 4 alcanos con radicales de alquilo como sustituyentes.
5- Los
halógenos es decir el séptimo grupo de la tabla periódica también se utilizan
como sustituyentes, escriba el nombre de los halógenos y su aplicación.
-----------------------------------------------------------
 I Periodo
I Periodo
Taller 3
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/TEMA: NOMENCLATURA ORGANICA
OBJETIVO: Identificar los prefijos y sufijos
utilizados para nombrar correctamente los compuestos orgánicos, teniendo en
cuenta las normas de la IUPAC.
MARCO CONCEPTUAL
La
Nomenclatura IUPAC es un sistema de nomenclatura de compuestos químicos y de
descripción de la ciencia y de la química en general. La nomenclatura IUPAC es
solo otro método de calcular compuestos químicos.
Las reglas para nombrar compuestos orgánicos e
inorgánicos están contenidas en dos publicaciones, conocidas como el Libro Azul
y el Libro Rojo, respectivamente. Una tercera publicación, conocida como el
Libro Verde, describe las recomendaciones para el uso de símbolos para
cantidades físicas (en asociación con la IUPAC), mientras que el cuarto, el
Libro Dorado, contiene las definiciones de un gran número de términos técnicos
usados en química. Una compilación similar existe para la bioquímica (en asociación
con el IUBMB), el análisis químico y la química macromolecular. Estos libros
están complementados por unas cortas recomendaciones para circunstancias
específicas las cuales son publicadas de vez en cuando en la Revista de Química
Pura y Aplicada.
TALLER
DE ACTIVIDADES.
De
acuerdo a la anterior lectura y al siguiente video contesten las preguntas a
continuación:
VIDEO CLICK AQUI https://youtu.be/dmf-hIjRdVg
1- Escriba
la importancia de la IUPAC para nombrar correctamente compuestos orgánicos.
2- Escriba
5 sustancias inorgánicas y 5 sustancias orgánicas con sus respectivas formulas
químicas y cuál es su diferencia.
3- Escriba
la formula estructural de 4 alcanos sin sustituyentes.
4- Escriba
la formula estructural de 4 alcanos con sustituyentes.
5- Escriba
3 ejemplos de alcanos donde se aplique las 5 normas de la IUPAC.
TEMA: NOMENCLATURA ORGANICA
OBJETIVO: Identificar los prefijos y sufijos
utilizados para nombrar correctamente los compuestos orgánicos, teniendo en
cuenta las normas de la IUPAC.
MARCO CONCEPTUAL
La Nomenclatura IUPAC es un sistema de nomenclatura de compuestos químicos y de descripción de la ciencia y de la química en general. La nomenclatura IUPAC es solo otro método de calcular compuestos químicos.
Las reglas para nombrar compuestos orgánicos e
inorgánicos están contenidas en dos publicaciones, conocidas como el Libro Azul
y el Libro Rojo, respectivamente. Una tercera publicación, conocida como el
Libro Verde, describe las recomendaciones para el uso de símbolos para
cantidades físicas (en asociación con la IUPAC), mientras que el cuarto, el
Libro Dorado, contiene las definiciones de un gran número de términos técnicos
usados en química. Una compilación similar existe para la bioquímica (en asociación
con el IUBMB), el análisis químico y la química macromolecular. Estos libros
están complementados por unas cortas recomendaciones para circunstancias
específicas las cuales son publicadas de vez en cuando en la Revista de Química
Pura y Aplicada.
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente video contesten las preguntas a continuación:
VIDEO CLICK AQUI https://youtu.be/dmf-hIjRdVg
1- Escriba
la importancia de la IUPAC para nombrar correctamente compuestos orgánicos.
2- Escriba
5 sustancias inorgánicas y 5 sustancias orgánicas con sus respectivas formulas
químicas y cuál es su diferencia.
3- Escriba
la formula estructural de 4 alcanos sin sustituyentes.
4- Escriba
la formula estructural de 4 alcanos con sustituyentes.
5- Escriba
3 ejemplos de alcanos donde se aplique las 5 normas de la IUPAC.
-------------------------------------------------------------
 I Periodo
I Periodo
Taller 2
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/TEMA: QUIMICA ORGANICAOBJETIVO: Valorar la importancia de la química orgánica en la formación de sustancias utilizadas en la cotidianidad a nivel médico, científico, alimenticio e industrial.MARCO CONCEPTUALQué es la Química orgánica: La química orgánica estudia la reacción química, propiedades y comportamientos de las estructuras basadas en moléculas de carbono y sus compuestos.La importancia de la química orgánica radica en el conocimiento molecular del carbono ya que está presente en todos los seres del planeta Tierra interactuando con el medio ambiente como, por ejemplo, en el ciclo del carbono. Se expresa como el logaritmo negativo de base 10 de la concentración de iones hidrógeno.Nomenclatura orgánica: La nomenclatura usada para la química orgánica hoy en día es un sistema implementado por la Unión internacional de química pura y aplicada (IUPAC) llamada también como nomenclatura sistemática.La nomenclatura orgánica se compone básicamente en un prefijo y en un sufijo. El prefijo determina el número de átomos de carbono que existen siendo las siguientes:1 carbono: met-2 carbonos: et-3 carbonos: prop-4 carbonos: but-5 carbonos: pent-6 carbonos: hex-7 carbonos: hept-8 carbonos: oct-9 carbonos: non-10 carbonos: dec-El sufijo de la nomenclatura orgánica determina la clase de compuesto orgánico. Los hidrocarburos, por ejemplo, son compuestos orgánicos que sólo contienen carbono e hidrógeno en su molécula y según el tipo de hibrocarburo el sufijo será diferente:Sufijo alcano: -ano. Ejemplo: metano, propano.Sufijo alquenos (doble enlaces de carbono): -eno, -dieno, -trieno y así sucesivamente.Sufijo alquinos (triple enlaces de carbono): -ino, -diino, -triino y así sucesivamente.Sufijo alquenos y alquinos compuestos con doble y triple enlace de carbono: -eninos. Ejemplo: eteno , propeno y etino. Son también conocidos en la nomenclatura vulgar como etileno, propileno y acetileno.
TALLER DE ACTIVIDADES.De acuerdo a la anterior lectura y al siguiente video contesten las preguntas a continuación:
1- Elabore un resumen de la importancia y la aplicación de la química orgánica en actividades prácticas cotidianas.2- Nombre 5 sustancias orgánicas, es decir que contienen carbono y en que se utilizan.3- Según la terminación de los compuestos orgánicos y utilizando los prefijos y sufijos escriba el nombre de los 10 primeros alcanos.4- Escriba el nombre de los 10 primeros alcoholes.5- Escriba el nombre de los 10 primeros alquenos.6- Dibuje el átomo de carbono con sus características.
--------------------------------------------------------------------------------------------------------------------------
GUÍA DIAGNOSTICA -ESTRATEGIA APRENDER EN CASA
ASIGNATURA: QUIMICA CURSO: GRADO ONCE
DOCENTE: GUSTAVO GOMEZ PUENTES









No hay comentarios:
Publicar un comentario