Taller 3
SECRETARIA DE EDUCACIÓN DEL DISTRITO INSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA TERCER PERIODO SEMANA DE TRABAJO DEL 17 AL 31 DE AGOSTO 2021 ASIGNATURA: QUIMICA CURSO: GRADO DECIMO DOCENTE: GUSTAVO GOMEZ PUENTES
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: CONFIGURACION DE LOS ELECTRONES.
OBJETIVO: Reconocer la distribución de los electrones
en los niveles y subniveles de energía presentes en los elementos químicos.
MARCO CONCEPTUAL.
La configuración electrónica es la distribución
de los electrones de un átomo o molécula (u otra estructura física) en atómicas
o orbitales moleculares. Por ejemplo, la configuración electrónica del neón átomo
es 1s 2 2s 2 2p 6 , utilizando la notación explica a continuación .
Configuraciones electrónicas describen cada
electrón como mover de forma independiente en un orbital, en un campo creado
por medio de todos los otros orbitales. Matemáticamente, las configuraciones se
describen por determinantes Slater o funciones de estado de configuración. De acuerdo
con las leyes de la mecánica cuántica, para sistemas con un solo electrón, un nivel
de energía está asociada con cada configuración electrónica y en ciertas
condiciones, los electrones son capaces de pasar de una configuración a otra
por la emisión o absorción de un quantum de energía, en forma de un fotón. El
conocimiento de la configuración electrónica de átomos diferentes es útil en la
comprensión de la estructura de la tabla periódica de elementos. Esto también
es útil para la descripción de los enlaces químicos que mantienen unidos a los
átomos. En materiales a granel, esta misma idea ayuda a explicar las propiedades
peculiares de los láseres y semiconductores.
NOTACIÓN
ESPECTRAL: Es la representación esquemática de la distribución de los electrones
de un átomo, de acuerdo con el modelo atómico de Bohr. Los electrones tienden a
ocupar orbítales de energía mínima.
NOTACION ELECTRONICA: Es la suma de los electrones de un elemento químico, en los
niveles de energía ejemplo: hallar la notación electrónica del mercurio (Hg).
Como el mercurio está en la casilla 80 de la
tabla periódica tiene la misma cantidad de electrones: K=2 * L=8 * M=18 * N=32 *
O=20, al sumar nos da los 80 electrones.
En la notación espectral se suman los
electrones en los subniveles de energía (s, p, d, f,) ejemplo: hallar la nación
espectral del fosforo (P), como esta en la casilla 15 de la tabla periódica
tiene la misma cantidad de electrones: 1S=2 * 2S=2 * 2P=6 * 3S=2 * 3P=3, Al sumar
nos da 15 electrones correspondiente al fosforo.
TALLER DE ACTIVIDADES.
De acuerdo al
siguiente video contestar:
1- Nombre los niveles de energía y escriba la
cantidad de electrones para cada uno.
2- Nombre los subniveles de energía y escriba la cantidad de electrones
para cada uno.
3- Dibuje un átomo y
ubique los 7 niveles
de energía en orden.
4- Haga la notación electrónica de 8 elementos químicos de la tabla
periódica.
5- Haga la notación espectral de 5 elementos químicos de la tabla
periódica. 6- Investigar 5 metales ligeros y
5 metales pesados.
7- Explique la fundición de metales en una acería
ejemplo (Paz del Rio).
8- Nombre 5 materiales metalúrgicos producidos en una acería y en que los utilizamos.
EVALUCACION:
Se tendrá en cuenta la puntualidad, creatividad, el orden y presentación del presente trabajo.
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: CONFIGURACION DE LOS ELECTRONES.
OBJETIVO: Reconocer la distribución de los electrones en los niveles y subniveles de energía presentes en los elementos químicos.
MARCO CONCEPTUAL.
La configuración electrónica es la distribución de los electrones de un átomo o molécula (u otra estructura física) en atómicas o orbitales moleculares. Por ejemplo, la configuración electrónica del neón átomo es 1s 2 2s 2 2p 6 , utilizando la notación explica a continuación .
Configuraciones electrónicas describen cada electrón como mover de forma independiente en un orbital, en un campo creado por medio de todos los otros orbitales. Matemáticamente, las configuraciones se describen por determinantes Slater o funciones de estado de configuración. De acuerdo con las leyes de la mecánica cuántica, para sistemas con un solo electrón, un nivel de energía está asociada con cada configuración electrónica y en ciertas condiciones, los electrones son capaces de pasar de una configuración a otra por la emisión o absorción de un quantum de energía, en forma de un fotón. El conocimiento de la configuración electrónica de átomos diferentes es útil en la comprensión de la estructura de la tabla periódica de elementos. Esto también es útil para la descripción de los enlaces químicos que mantienen unidos a los átomos. En materiales a granel, esta misma idea ayuda a explicar las propiedades peculiares de los láseres y semiconductores.
NOTACIÓN ESPECTRAL: Es la representación esquemática de la distribución de los electrones de un átomo, de acuerdo con el modelo atómico de Bohr. Los electrones tienden a ocupar orbítales de energía mínima.
NOTACION ELECTRONICA: Es la suma de los electrones de un elemento químico, en los niveles de energía ejemplo: hallar la notación electrónica del mercurio (Hg).
Como el mercurio está en la casilla 80 de la
tabla periódica tiene la misma cantidad de electrones: K=2 * L=8 * M=18 * N=32 *
O=20, al sumar nos da los 80 electrones.
En la notación espectral se suman los
electrones en los subniveles de energía (s, p, d, f,) ejemplo: hallar la nación
espectral del fosforo (P), como esta en la casilla 15 de la tabla periódica
tiene la misma cantidad de electrones: 1S=2 * 2S=2 * 2P=6 * 3S=2 * 3P=3, Al sumar
nos da 15 electrones correspondiente al fosforo.
TALLER DE ACTIVIDADES.
De acuerdo al siguiente video contestar:
1- Nombre los niveles de energía y escriba la cantidad de electrones para cada uno.
2- Nombre los subniveles de energía y escriba la cantidad de electrones
para cada uno.
3- Dibuje un átomo y ubique los 7 niveles de energía en orden.
4- Haga la notación electrónica de 8 elementos químicos de la tabla periódica.
5- Haga la notación espectral de 5 elementos químicos de la tabla periódica. 6- Investigar 5 metales ligeros y 5 metales pesados.
7- Explique la fundición de metales en una acería ejemplo (Paz del Rio).
8- Nombre 5 materiales metalúrgicos producidos en una acería y en que los utilizamos.
EVALUCACION: Se tendrá en cuenta la puntualidad, creatividad, el orden y presentación del presente trabajo.
________________________________________
Taller 1
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA TERCER PERIODO SEMANA DE TRABAJO DEL 15 AL 29 DE JULIO 2021 ASIGNATURA: QUIMICA CURSO: GRADO DECIMO DOCENTE: GUSTAVO GOMEZ PUENTES
El presente trabajo
debe ser solucionado y enviado a su director
de curso, al correo que habitualmente utilizan
para el manejo de información y comunicación de estudiantes y padres de familia.
NOTA:
El presente trabajo
se debe hacer en el cuaderno, cuando se pida la explicación de un tema máximo el resumen debe ocupar media hoja y tomar una foto donde
se vea claramente el trabajo desarrollado en el cuaderno y enviar al
director del grupo o al siguiente
correo ggomezpuentes@gmail.com o al whatssap
3213432395
TEMA: Moles, Moléculas, Gramos.
Objetivo: Identificar las moles o gramos presentes en un elemento
o compuesto químico.
Las moles se hallan aplicando regla de 3 simples. Ejemplo: cuantas moles hay en 20 gramos
de agua. Solución= 1 Mol de agua pesa 18 gramos.
Favor recordar
los pesos de los elementos químicos.
En las reacciones químicas intervienen partículas muy
pequeñas como átomos, iones moléculas; para contar y pesar tales partículas, el químico cuanta con
ciertas unidades que se llaman
unidades químicas, siendo
las principales: Peso atómico Átomo gramo
Molécula gramo Mol Peso molecular Volumen molar o Volumen molecular gramo Peso atómico Es el peso promedio de
los átomos de un elemento en relación con el peso de un átomo
de carbono 12, al cual se le ha asignado
el peso de 12 unidades
de peso atómico o de masa atómica. El peso atómico de un elemento es
proporcional al peso real de un
átomo, ya que indica cuántas veces es mayor el peso real de dicho elemento
que la doceava parte del peso de un átomo de carbono
12. Por ejemplo:
el peso atómico del magnesio
es igual a 24.312uma, lo que significa
que un átomo de magnesio pesa aproximadamente el doble de un átomo de
carbono 12.El valor de 4.003umapara el peso atómico
del helio indica que un átomo de helio pesa aproximadamente la tercera
parte de un átomo de carbono 12.Átomo
gramoEs el peso atómico
de un elemento expresado en gramos. Por ejemplo:1.Un átomo-gramo de oxígeno
pesa 16 gramos.2.Un átomo-gramo de nitrógeno pesa 14 gramos.3.Un átomo- gramo de carbono
pesa 12 gramos.
TALLER DE ACTIVIDADES:
1-
Realice 10 problemas de moles.
2-
Realice 10 problemas de gramos.
3- Escriba 20 elementos químicos
con su peso atómico
4- .En los espacios en blanco, escribe
la palabra o palabras que completen los siguientes
enunciados:
Es la suma de los pesos atómicos de los elementos que forman
una molécula
Es el peso atómico
de un elemento expresado en gramos
Es el peso molecular expresado en gramos
Es el promedio de
los
pesos
atómicos de
los
átomos
de
un
elemento ____________
Es el valor
del número de Avogadro
Fórmula para calcular el número de moles
5-. Determina
los pesos moleculares de los siguientes compuestos: H2O, CO2 KHSO4,
K2CrO4, Pb(NO3)2, NH4OH, Al2(SO4)
EVALUACION: Se
tendrá en cuenta la puntualidad, creatividad, orden y presentación del presente
trabajo.
El presente trabajo debe ser solucionado y enviado a su director de curso, al correo que habitualmente utilizan para el manejo de información y comunicación de estudiantes y padres de familia.
NOTA: El presente trabajo se debe hacer en el cuaderno, cuando se pida la explicación de un tema máximo el resumen debe ocupar media hoja y tomar una foto donde se vea claramente el trabajo desarrollado en el cuaderno y enviar al director del grupo o al siguiente correo ggomezpuentes@gmail.com o al whatssap 3213432395
TEMA: Moles, Moléculas, Gramos.
Objetivo: Identificar las moles o gramos presentes en un elemento o compuesto químico.
Las moles se hallan aplicando regla de 3 simples. Ejemplo: cuantas moles hay en 20 gramos de agua. Solución= 1 Mol de agua pesa 18 gramos.
Favor recordar los pesos de los elementos químicos.
En las reacciones químicas intervienen partículas muy pequeñas como átomos, iones moléculas; para contar y pesar tales partículas, el químico cuanta con ciertas unidades que se llaman unidades químicas, siendo las principales: Peso atómico Átomo gramo Molécula gramo Mol Peso molecular Volumen molar o Volumen molecular gramo Peso atómico Es el peso promedio de los átomos de un elemento en relación con el peso de un átomo de carbono 12, al cual se le ha asignado el peso de 12 unidades de peso atómico o de masa atómica. El peso atómico de un elemento es proporcional al peso real de un átomo, ya que indica cuántas veces es mayor el peso real de dicho elemento que la doceava parte del peso de un átomo de carbono 12. Por ejemplo: el peso atómico del magnesio es igual a 24.312uma, lo que significa que un átomo de magnesio pesa aproximadamente el doble de un átomo de carbono 12.El valor de 4.003umapara el peso atómico del helio indica que un átomo de helio pesa aproximadamente la tercera parte de un átomo de carbono 12.Átomo gramoEs el peso atómico de un elemento expresado en gramos. Por ejemplo:1.Un átomo-gramo de oxígeno pesa 16 gramos.2.Un átomo-gramo de nitrógeno pesa 14 gramos.3.Un átomo- gramo de carbono pesa 12 gramos.
TALLER DE ACTIVIDADES:
1-
Realice 10 problemas de moles.
2-
Realice 10 problemas de gramos.
3- Escriba 20 elementos químicos con su peso atómico
4- .En los espacios en blanco, escribe la palabra o palabras que completen los siguientes enunciados:
Es la suma de los pesos atómicos de los elementos que forman una molécula
Es el peso atómico de un elemento expresado en gramos
Es el peso molecular expresado en gramos
Es el promedio de los pesos atómicos de los átomos de un elemento ____________
Es el valor del número de Avogadro
Fórmula para calcular el número de moles
5-. Determina los pesos moleculares de los siguientes compuestos: H2O, CO2 KHSO4, K2CrO4, Pb(NO3)2, NH4OH, Al2(SO4)
EVALUACION: Se tendrá en cuenta la puntualidad, creatividad, orden y presentación del presente trabajo.
________________________________________
Taller 2
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA N°2 SEGUNDO PERIODO APRENDER EN CASASEMANA DE TRABAJO DEL 03 AL 14 DE MAYO 2021 ASIGNATURA: QUIMICA CURSO: GRADO DECIMO DOCENTE: GUSTAVO GOMEZ PUENTES
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: TEMPERATURA DE LOS CUERPOS
OBJETIVO: Identificar las diferentes escalas de temperatura y las unidades de
compresión en la resolución de problemas.
MARCO CONCEPTUAL
La temperatura es el grado de calor de los cuerpos (36 ºC es la temperatura normal del cuerpo humano). Existen distintas escalas
para medir la temperatura. Estas son las más usadas tanto en la vida común como
en las ciencias.
Escala Celsius
o CENTIGRADA:
La escala Celsius fue inventada en 1742 por el astrónomo sueco Andrés
Celsius. Esta escala divide el rango entre las temperaturas de congelación y de
ebullición del agua en 100 partes iguales. Usted encontrará a veces esta escala
identificada como escala centígrada. Las temperaturas en la escala Celsius son
conocidas como grados Celsius (ºC).
FORMULA: ºC = 5/9 x (ºF-32)
EJEMPLO: Pasar
40ºF a grados centígrados (ºC).
SOLUCIÓN:
ºC = 5/9 x (ºF-32)
ºC = 5/9 x (40-32)
ºC = 5/9 x 8
ºC= 40/9
ºC= 4,44
Escala
Fahrenheit
fue establecida por el físico holandés-alemán Gabriel Daniel Fahrenheit,
en 1724. la escala Fahrenheit es ampliamente usada en los Estados Unidos. Esta
escala divide la diferencia entre los puntos de fusión y de ebullición del agua
en 180 intervalos iguales. Las temperaturas en la escala Fahrenheit son
conocidas como grados Fahrenheit (ºF).
FORMULA: ºF = 9/5 x ºC + 32.
EJEMPLO: Pasar
10ºC a grados Fahrenheit (ºF).
SOLUCIÓN:
ºF = 9/5 x ºC + 32.
ºF = (9/5 x 10) + 32.
ºF= 90/5 + 32
ºF= 18 +32
ºF= 50
Escala de
Kelvin
Lleva el nombre de William Thompson Kelvin, un físico británico que la
diseñó en 1848. No tiene valores negativos. Se usa en laboratorios. Las
temperaturas en esta escala son llamadas Kelvins (K).
FORMULA: ºK = ºC + 273
EJEMPLO: Pasar
27ºC a grados Kelvin
SOLUCIÓN:
ºK = ºC + 273
ºK = 27 + 273
ºK = 300
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente video
contesten las preguntas a continuación:
1.
Dibuje las principales
escalas de temperatura con sus valores representativos.
2.
Defina las
escalas de temperatura de Fahrenheit, centígrados y Kelvin explicando sus principales
características.
3.
Plantee y solucione 3 problemas relacionados con temperatura en grados Fahrenheit.
4.
Plantee y solucione 3
problemas relacionados con temperatura en grados centígrados.
5.
Plantee y solucione 3 problemas relacionados con temperatura en grados Kelvin.
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: TEMPERATURA DE LOS CUERPOS
OBJETIVO: Identificar las diferentes escalas de temperatura y las unidades de
compresión en la resolución de problemas.
MARCO CONCEPTUAL
La temperatura es el grado de calor de los cuerpos (36 ºC es la temperatura normal del cuerpo humano). Existen distintas escalas
para medir la temperatura. Estas son las más usadas tanto en la vida común como
en las ciencias.
Escala Celsius
o CENTIGRADA:
La escala Celsius fue inventada en 1742 por el astrónomo sueco Andrés
Celsius. Esta escala divide el rango entre las temperaturas de congelación y de
ebullición del agua en 100 partes iguales. Usted encontrará a veces esta escala
identificada como escala centígrada. Las temperaturas en la escala Celsius son
conocidas como grados Celsius (ºC).
FORMULA: ºC = 5/9 x (ºF-32)
EJEMPLO: Pasar
40ºF a grados centígrados (ºC).
SOLUCIÓN:
ºC = 5/9 x (ºF-32)
ºC = 5/9 x (40-32)
ºC = 5/9 x 8
ºC= 40/9
ºC= 4,44
Escala
Fahrenheit
fue establecida por el físico holandés-alemán Gabriel Daniel Fahrenheit,
en 1724. la escala Fahrenheit es ampliamente usada en los Estados Unidos. Esta
escala divide la diferencia entre los puntos de fusión y de ebullición del agua
en 180 intervalos iguales. Las temperaturas en la escala Fahrenheit son
conocidas como grados Fahrenheit (ºF).
FORMULA: ºF = 9/5 x ºC + 32.
EJEMPLO: Pasar
10ºC a grados Fahrenheit (ºF).
SOLUCIÓN:
ºF = 9/5 x ºC + 32.
ºF = (9/5 x 10) + 32.
ºF= 90/5 + 32
ºF= 18 +32
ºF= 50
Escala de
Kelvin
Lleva el nombre de William Thompson Kelvin, un físico británico que la
diseñó en 1848. No tiene valores negativos. Se usa en laboratorios. Las
temperaturas en esta escala son llamadas Kelvins (K).
FORMULA: ºK = ºC + 273
EJEMPLO: Pasar
27ºC a grados Kelvin
SOLUCIÓN:
ºK = ºC + 273
ºK = 27 + 273
ºK = 300
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente video
contesten las preguntas a continuación:
1.
Dibuje las principales
escalas de temperatura con sus valores representativos.
2.
Defina las
escalas de temperatura de Fahrenheit, centígrados y Kelvin explicando sus principales
características.
3.
Plantee y solucione 3 problemas relacionados con temperatura en grados Fahrenheit.
4.
Plantee y solucione 3
problemas relacionados con temperatura en grados centígrados.
5. Plantee y solucione 3 problemas relacionados con temperatura en grados Kelvin.
_________________________________________
Taller 1
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA N°1 SEGUNDO PERIODO APRENDER EN CASASEMANA DE TRABAJO DEL 19 DE ABRIL A 30 DE ABRIL 2021ASIGNATURA: QUIMICA CURSO: GRADO DECIMO DOCENTE: GUSTAVO GOMEZ PUENTES
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: FÓRMULAS QUIMICAS
OBJETIVO: Identificar las formulas químicas
tanto como moleculares como estructurales, dependiendo de la cantidad de átomos
presentes y su distribución electrónica.
MARCO CONCEPTUAL
Una fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula.
Fórmula molecular, es la fórmula real de la
molécula, nos indica los tipos de átomos y el número de cada tipo que
participan en la formación de la molécula. Por ejemplo, la fórmula
molecular de la glucosa, C6H12O6, nos dice que
cada molécula se compone de 6 átomo de C, 12 átomos de hidrógeno y 6 átomos de
oxígeno.
Fórmula estructural, muestra la forma en que se
unen los diferentes átomos para dar lugar a la molécula. Por ejemplo, el
ácido acético tiene de fórmula molecular, C2H4O2,
que no indica como se unen los 8 átomos que componen la molécula. La
fórmula estructural nos muestra que uno de los carbonos se une mediante enlaces
simples a tres hidrógenos y al segundo carbono. Por su parte, el segundo
carbono forma un enlace doble con el primer oxígeno y un enlace simple
con el segundo que a su vez une a un hidrógeno.
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente video
contesten las preguntas a continuación:
1.
¿Qué es formula molecular? Escriba 3 ejemplos
2.
¿Qué es formula estructural? Escriba 5 ejemplos.
3.
¿Cuál es la importancia de las fórmulas químicas?
4.
Identifique la cantidad de átomos y elementos
presentes en la glucosa y cuál es la aplicación de este compuesto.
5.
Identifique la cantidad de átomos y elementos
presentes en el ácido acético y cuál es la aplicación de este compuesto.
6.
Escriba la formula química de 3 sustancias
presentes en la orina y que función cumple en la eliminación de residuos.
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: FÓRMULAS QUIMICAS
OBJETIVO: Identificar las formulas químicas
tanto como moleculares como estructurales, dependiendo de la cantidad de átomos
presentes y su distribución electrónica.
MARCO CONCEPTUAL
Una fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula.
Fórmula molecular, es la fórmula real de la
molécula, nos indica los tipos de átomos y el número de cada tipo que
participan en la formación de la molécula. Por ejemplo, la fórmula
molecular de la glucosa, C6H12O6, nos dice que
cada molécula se compone de 6 átomo de C, 12 átomos de hidrógeno y 6 átomos de
oxígeno.
Fórmula estructural, muestra la forma en que se
unen los diferentes átomos para dar lugar a la molécula. Por ejemplo, el
ácido acético tiene de fórmula molecular, C2H4O2,
que no indica como se unen los 8 átomos que componen la molécula. La
fórmula estructural nos muestra que uno de los carbonos se une mediante enlaces
simples a tres hidrógenos y al segundo carbono. Por su parte, el segundo
carbono forma un enlace doble con el primer oxígeno y un enlace simple
con el segundo que a su vez une a un hidrógeno.
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente video
contesten las preguntas a continuación:
1.
¿Qué es formula molecular? Escriba 3 ejemplos
2.
¿Qué es formula estructural? Escriba 5 ejemplos.
3.
¿Cuál es la importancia de las fórmulas químicas?
4.
Identifique la cantidad de átomos y elementos
presentes en la glucosa y cuál es la aplicación de este compuesto.
5.
Identifique la cantidad de átomos y elementos
presentes en el ácido acético y cuál es la aplicación de este compuesto.
6.
Escriba la formula química de 3 sustancias
presentes en la orina y que función cumple en la eliminación de residuos.
--------------------------------------------------------------Taller 4
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA DE NIVELACION N°4 ESTRATEGIA APRENDER EN CASASEMANA DE TRABAJO DEL 16 DE MARZO A 28 DE MARZO 2021ASIGNATURA: QUIMICA CURSO: GRADO DECIMODOCENTE: GUSTAVO GOMEZ PUENTES
La solución del presente trabajo, debe ser enviado al
correo electrónico ggomezpuentes@gmail.com o WhatsApp
3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: MASA Y GRAMOS
OBJETIVO: Identificar las unidades de masa y
aplicar los conceptos en la solución de problemas cotidianos.
MARCO CONCEPTUAL
Masa
Molecular:
Dos o más
átomos se combinan para formar estructuras estables denominadas moléculas. La
unión entre átomos se denomina enlace (y lo estudiaremos en el tema siguiente)
La masa
molecular (M r) es igual a la suma de las masas atómicas relativas de los
átomos de la fórmula de dicha sustancia:
M r (H 2SO 4)
= 2 A r (H) + Ar (S) + 4 A r (O) =
= 2 × 1.0 + 32.0 + 4
× 16.0 = 98.0
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente video
contesten las preguntas a continuación:
DESCARGAR VIDEO AQUI
1.
Explique la
definición de masa y ejemplos de unidades de masa.
2.
Dibuje 5 aparatos
de medición de masa.
3.
Plantee y
solucione 5 problemas de masa.
4.
Nombre 5
sustancias químicas y halle su masa molecular
5.
Elabore
un cuadro comparativo entre el volumen y la masa de los cuerpos.
La solución del presente trabajo, debe ser enviado al
correo electrónico ggomezpuentes@gmail.com o WhatsApp
3213432395
Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com/
TEMA: MASA Y GRAMOS
OBJETIVO: Identificar las unidades de masa y
aplicar los conceptos en la solución de problemas cotidianos.
MARCO CONCEPTUAL
Masa
Molecular:
Dos o más
átomos se combinan para formar estructuras estables denominadas moléculas. La
unión entre átomos se denomina enlace (y lo estudiaremos en el tema siguiente)
La masa
molecular (M r) es igual a la suma de las masas atómicas relativas de los
átomos de la fórmula de dicha sustancia:
M r (H 2SO 4)
= 2 A r (H) + Ar (S) + 4 A r (O) =
= 2 × 1.0 + 32.0 + 4
× 16.0 = 98.0
TALLER
DE ACTIVIDADES.
De acuerdo a la anterior lectura y al siguiente video
contesten las preguntas a continuación:
DESCARGAR VIDEO AQUI
1.
Explique la
definición de masa y ejemplos de unidades de masa.
2.
Dibuje 5 aparatos
de medición de masa.
3.
Plantee y
solucione 5 problemas de masa.
4.
Nombre 5
sustancias químicas y halle su masa molecular
5.
Elabore
un cuadro comparativo entre el volumen y la masa de los cuerpos.
--------------------------------------------------------------Taller 3
SECRETARIA DE EDUCACIÓN DEL DISTRITOINSTITUCIÓN EDUCATIVA DISTRITAL JOSÉ ANTONIO GALÁNGUÍA DE NIVELACION N°3 ESTRATEGIA APRENDER EN CASASEMANA DE TRABAJO DEL 01 DE MARZO A 14 DE MARZO 2021ASIGNATURA: QUIMICA CURSO: GRADO DECIMODOCENTE: GUSTAVO GOMEZ PUENTES
La solución del presente trabajo, debe ser enviado al correo electrónico ggomezpuentes@gmail.com o WhatsApp 3213432395Dirección de blog institucional: https://joseantoniogalanbosa.blogspot.com
-------------------------------------------------------------
 Indica que el estado del oxígeno es gaseoso.Los coeficientes indican la cantidad de moléculas que intervienen en las reacciones.
Indica que el estado del oxígeno es gaseoso.Los coeficientes indican la cantidad de moléculas que intervienen en las reacciones.

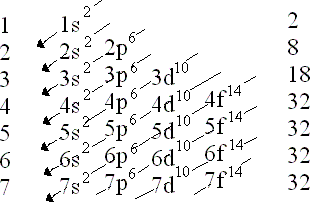







Este comentario ha sido eliminado por un administrador del blog.
ResponderEliminar